漫长的进化赋予细胞多种具膜细胞器,如线粒体、叶绿体等。细胞器在实现细胞功能的空间调控方面发挥着关键作用,从而保证细胞内成千上万的反应有条不紊地进行。然而,人工构建的用于绿色生物制造的微生物细胞往往缺乏特定的微反应器,面临反应效率低下、终产物浓度低的问题,严重制约了绿色生物化工的发展。
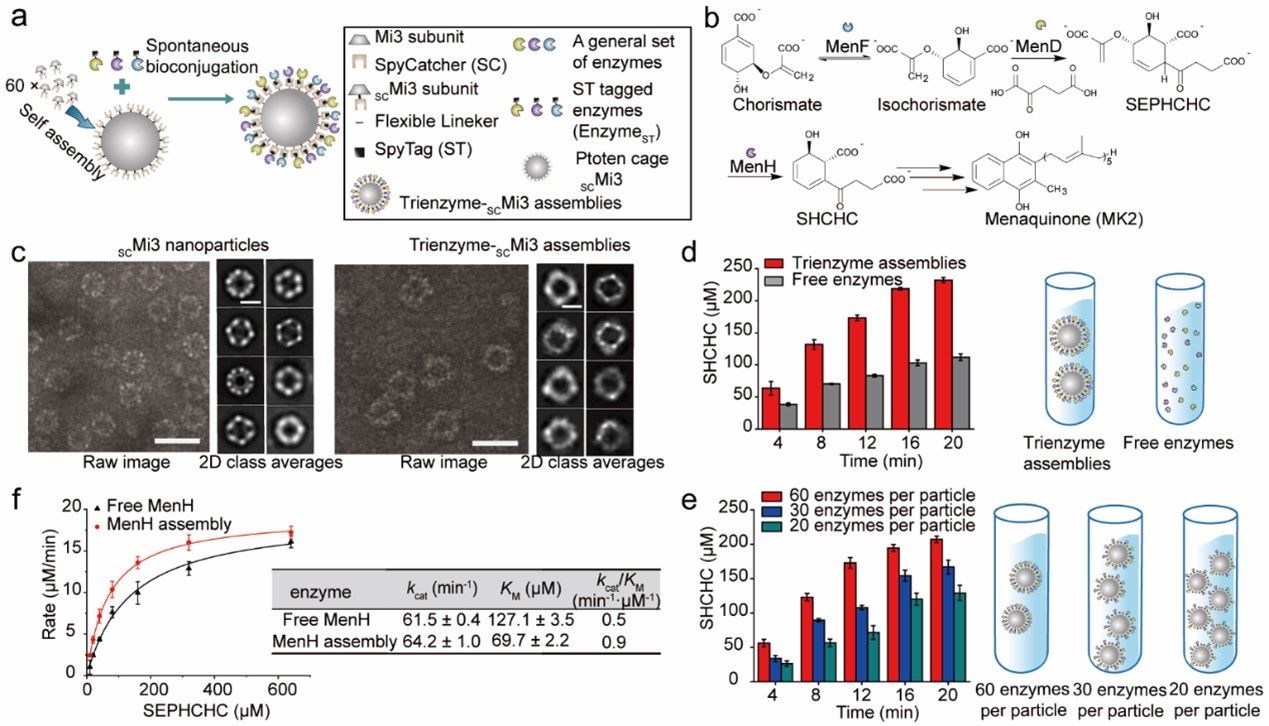
近日,生物工程学院薛闯教授团队利用自组装蛋白质笼结构,构建了一种仿生类细胞器,用于促进人工代谢途径的反应效率。由自组装蛋白质笼构成的微细胞器可将酶分子募集在蛋白质笼表面,实现酶分子的高度空间组织性,拉进酶分子间的距离,促进中间代谢产物传输,提高反应效率。相比游离酶,定位于类细胞器的酶分子表现出了更强的底物亲和力,可以争夺更多细胞资源,助力产物合成。研究团队将该微细胞器应用于番茄红素的生物合成,将参与级联反应的三种关键酶共定位于微反应器的表面,成功提高了合成途径的整体代谢流,并最终实现番茄红素产量的大幅提升(8.5倍)。
上述相关研究成果发表于化学领域顶级期刊《德国应用化学》,文章题目为“Organizing Enzymes on Self-Assembled Protein Cages for Cascade Reactions”。大连理工大学薛闯教授与肯尼索州立大学李博教授为通讯作者,大连理工大学副教授康巍与博士研究生马骁为论文第一作者。大连理工大学为第一完成单位。以上研究项目得到了国家重点研发计划、国家自然科学基金、中央高校基本科研业务费专项资金等经费支持。

薛闯教授负责的合成生物学与生物催化团队致力于化学工程与生物技术的结合,围绕生物催化转化的基础科学问题和创新技术开展研究工作。目前,薛闯教授课题组已在生物质资源化利用、生物燃料制备、工业微生物工程改造、发酵过程优化及工程放大、微生物与酶催化转化研究、生物医药等生物基化学品的制备等方面取得诸多重要进展。团队康巍副教授的主要研究兴趣为化学生物学与合成生物学的交叉学科,围绕生物大分子自组装结构,针对生物中最重要的高分子化合物、多种生命功能的实际执行者——蛋白质,建立可控的蛋白质自组装方法,构建功能“蛋白质乐高积木”。一方面通过模拟天然蛋白质复合物解析蛋白质复合物的协同和调节机制,另一方面将人工蛋白质复合物应用于合成生物学、生物医药及生物材料等领域,解决产业界的技术难题。