化学学院张志超教授课题组近日在Cellular & Molecular Biology Letters(中科院生物大类一区)发表成果,利用原创小分子抑制剂作为工具,通过化学蛋白质组学技术、细胞生物学、生物化学等研究方法,揭示由热休克蛋白70(Hsp70)与其辅助伴侣蛋白Bim所介导的线粒体自噬调控新通路,为癌症治疗提供了新靶标,以及依赖这一新机制的新结构抗癌候选药物分子。
自噬是一种高度保守的溶酶体降解分解代谢过程,细胞通过自噬从受损的细胞器和蛋白质中回收营养物质来维持细胞内稳态。但是肿瘤细胞也能够通过自噬克服逆境,是肿瘤对抗癌治疗产生耐药性的主要原因。因此,只有选择性干预肿瘤自噬的药物才能克服肿瘤耐药,不影响正常细胞的生理过程。现有的自噬调控分子或者缺乏特异性,导致毒性,或者活性偏低,因此尚未获得FDA批准。
相对于基础自噬的非选择性降解过程,肿瘤细胞利用异常激活的线粒体自噬增强细胞对逆境的耐受性,在肿瘤耐药、干性维持、肿瘤复发等过程中发挥重要作用。深入研究线粒体自噬发生的分子机制能够为新的抗癌策略提供靶点和理论依据。
张志超课题组建立了靶向线粒体凋亡和自噬的小分子化合物筛选平台,基于该平台发现了首个靶向Hsp70/Bim二聚体诱导线粒体凋亡的抑制剂S1g-2(N-(6-环己基巯基-2-氰基-1-羰基-非那烯)-3-氨基丙酸甲酯),在慢性粒细胞白血病中表现出治疗潜力(J. Bio. Chem.,2020,295, 12900;Leukemia.,2021, 35, 2862)。近日,该研究团队利用S1g-2及其衍生物分子作为分子工具,揭示Hsp70/Bim二聚体通过招募E3连接酶PARKIN和线粒体外膜蛋白TOMM20,促进PARKIN向线粒体转移,激活TOMM20的泛素化修饰,促进线粒体自噬。肿瘤细胞利用该机制特异性抵御多种外界刺激诱导的线粒体凋亡,维持细胞稳态。因此,Hsp70/Bim二聚体是一个自噬靶向的抗癌靶标。S1g-2代表了新的自噬调节剂类的抗癌先导药物分子。其抑制线粒体自噬的活性高于目前唯一进入临床试验阶段的自噬抑制剂氯喹3-5倍。
尤其是,本研究揭示Bim蛋白连通了凋亡和自噬两个过程,增加了细胞信号转导网络的鲁棒性,不仅加深了分子层面对细胞稳态维持机制的认识,扩展了肿瘤靶标,还发现了S1g-2分子通过特异性解离Hsp70/Bim二聚体,同时通过诱导肿瘤细胞的内源性凋亡和通过抑制肿瘤的线粒体自噬促进其凋亡。该分子对Bcr-Abl非依赖性耐药的慢性粒细胞白血病具有高于格列卫50倍左右的杀伤活性,反映了其双重促凋亡机制决定的高效、低毒的抗癌表现,也证明Hsp70/Bim是凋亡-自噬双网络的关键节点,是值得重点关注的抗癌靶标。
本研究基于化学生物学的研究思路,实现了靶标发现—抗癌先导化合物研发一体化的研究。
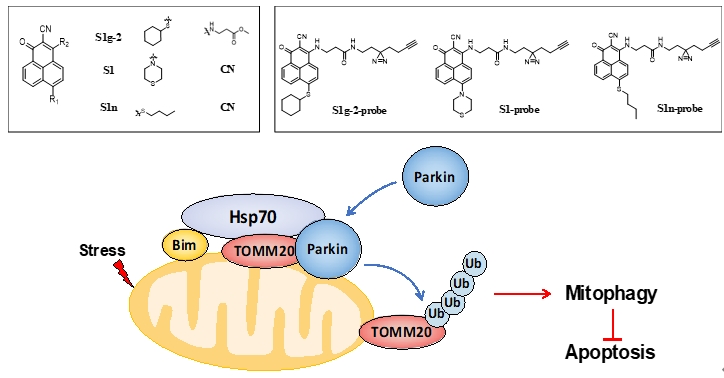
Hsp70/Bim调控线粒体自噬的分子机制模式图
论文发表于Cellular & Molecular Biology Letters,DOI: 10.1186/s11658-023-00458-5。化学学院宋婷副教授为论文第一作者。该研究得到了国家自然科学基金及医工合作项目的资助。
全文:Ting Song, Fangkui Yin, Ziqian Wang, Hong Zhang, Peng Liu, Yafei Guo, Yao Tang, Zhichao Zhang*Cellular & Molecular Biology Letters,2023, 28:46, DOI: 10.1186/s11658-023-00458-5